FORMULÁRIOS:
▪ Implantologia: para cobertura de antrostomia
e para a proteção de enxertos realizados em defeitos
de duas paredes.
▪ Periodontologia: proteção de enxerto em defeitos
infraóssea quando a sutura das bordas apresenta
risco de exposição.
Fornece estabilização na área do enxerto e um
proteção de longa duração contra agentes externos. No
elevação do seio nasal com acesso lateral, a membrana é
indicado para cobrir a antrostomia e proteger o
membrana sinusal em risco de laceração devido a
pressão do enxerto. Também pode ser usado para
proteger a regeneração perimplantar e enxertos
periodontal.
APRESENTAÇÃO:
10×15 mm x 0,5mm, 15x20mm x 0,5mm ou unidades de 20x30mm x 0,5mm
Embalagem blister selada.
FORMULÁRIOS

Observação: Material a ser usado em sua totalidade e em
um único receptor.
Usos pretendidos
IMPLANTOLOGIA:
Para a cobertura da antrostomia e para a proteção de enxertos feitos em defeitos de duas paredes.
PERIODONTICS:
Proteção de enxertos em defeitos infra-ósseos quando a sutura das bordas apresenta risco de exposição.
Proporciona estabilização na área do enxerto e proteção duradoura contra agentes externos.
Na elevação do seio com acesso lateral, a membrana é indicada para cobrir o
antrostomia e proteger a membrana sinusal do risco de laceração devido à pressão do enxerto. Ele também pode ser usado para proteger a regeneração perimplantar e enxertos periodontais.
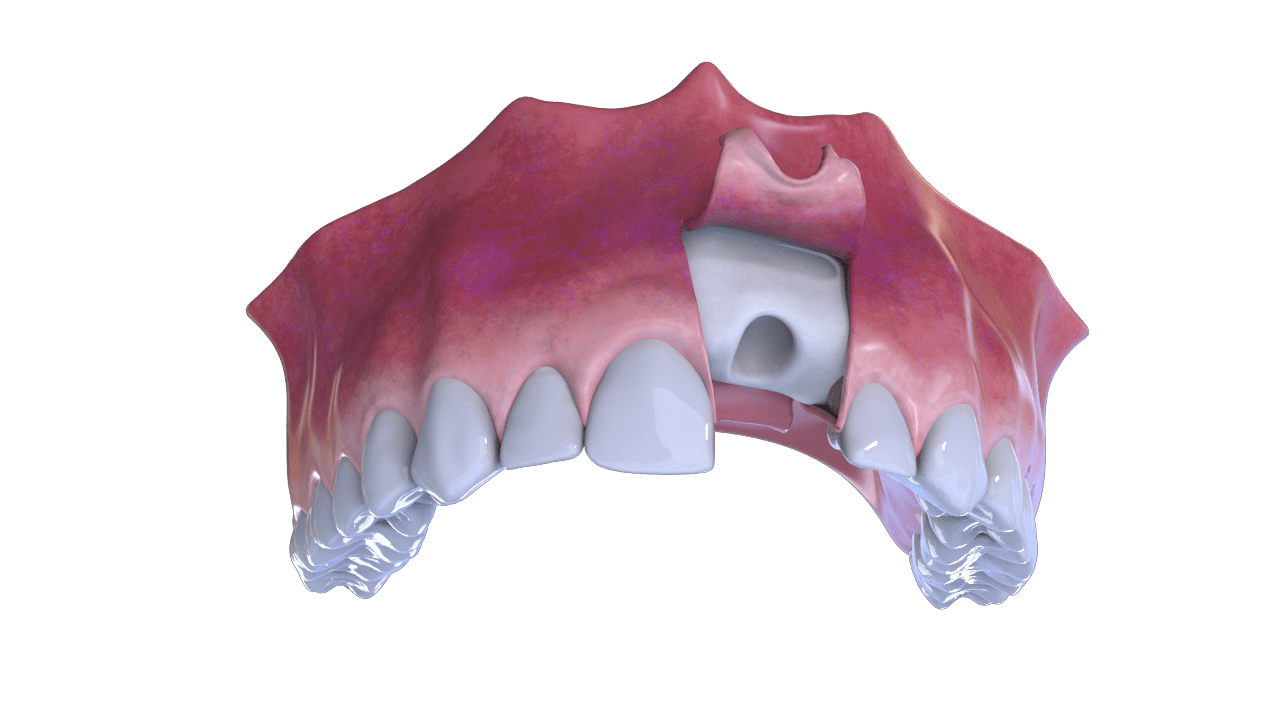
ESTÁGIOS DO PROCESSO
1° Fase
Incisão
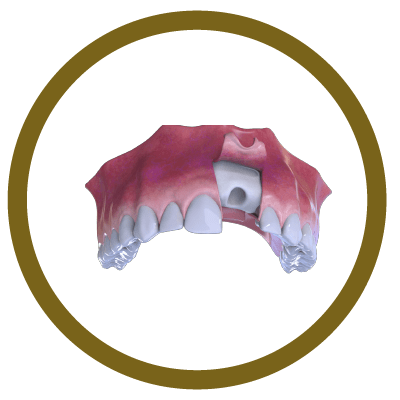
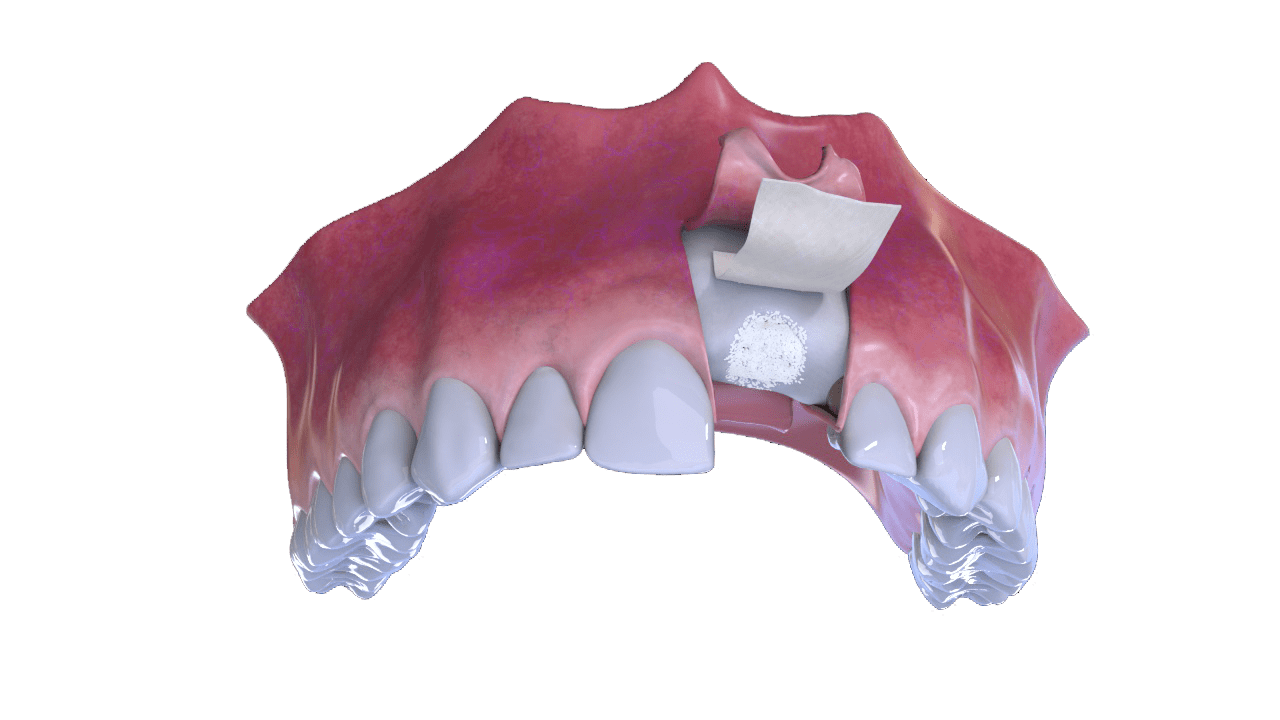
2° Fase
Colocação de osso e membrana (capa)
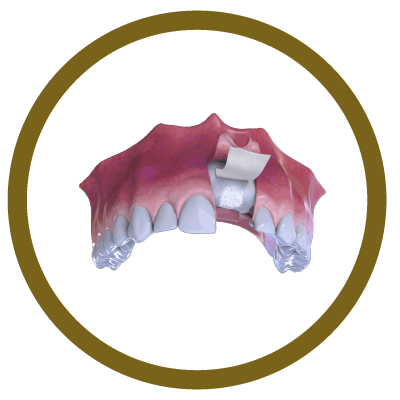
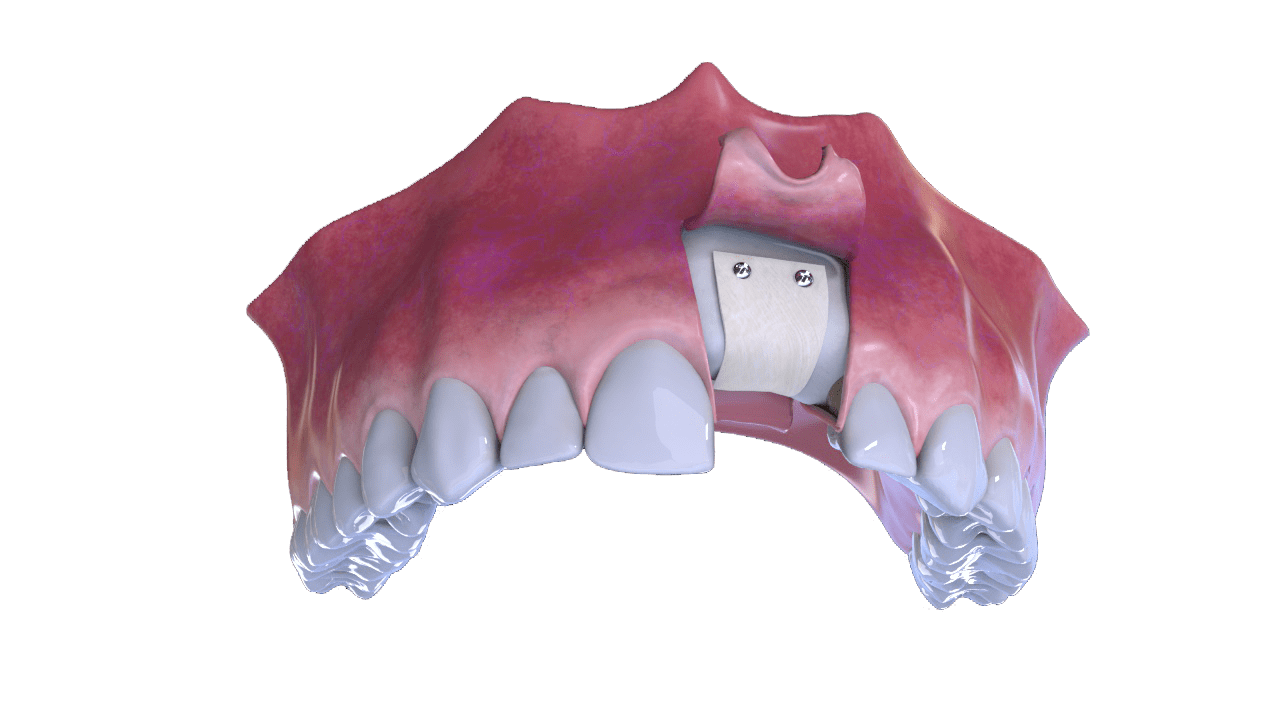
3° Fase
Colocação de osso e membrana (capa)
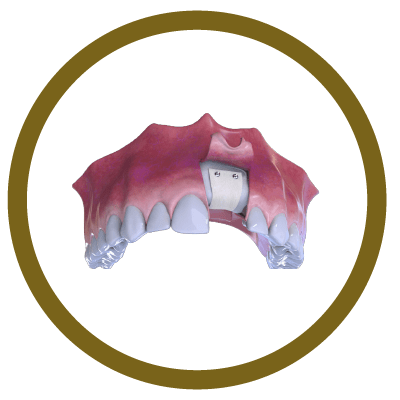
4° Fase
Sutura
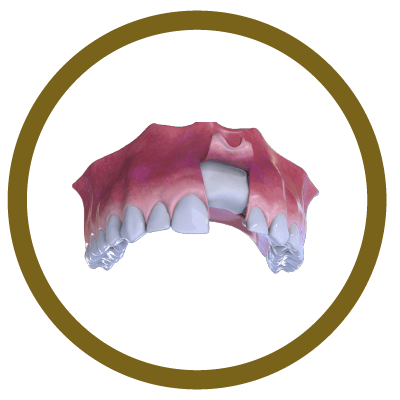
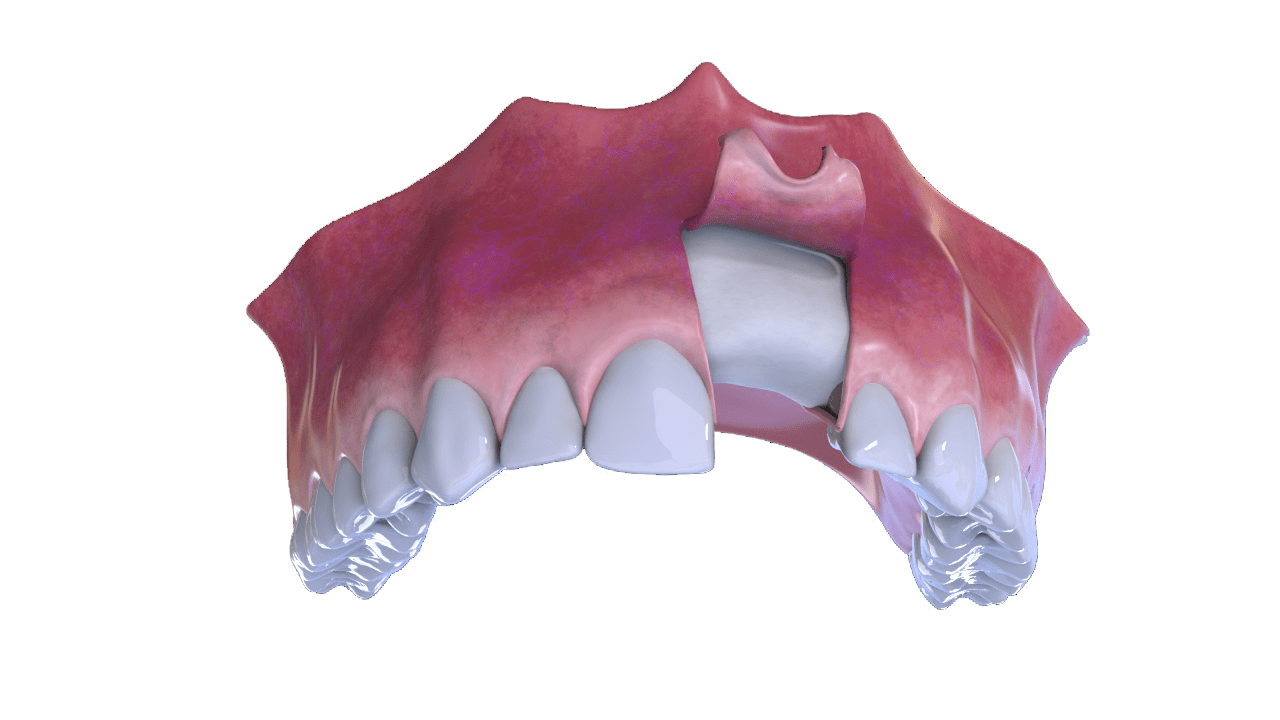
5° Fase
Nova formação óssea
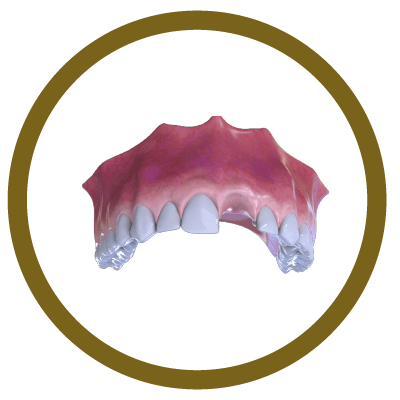
6° Fase
Conclusão (com implante e coroa)
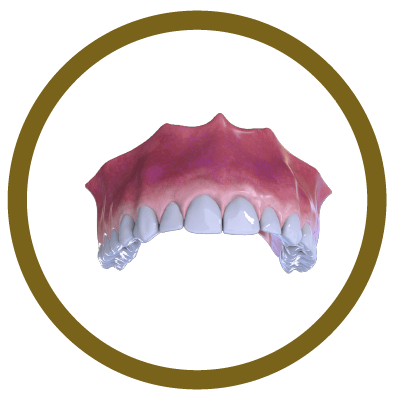
INFORMAÇÃO TÉCNICA
Descarga direta
Segurança e eficácia do produto médico
A certificação dos animais de que provém a matéria-prima são originalmente criados, alimentados e abatidos no território da República Argentina. A matéria-prima é mantida armazenada em freezers com controladores térmicos instalados que garantem as condições de armazenamento e mantêm o tecido suíno dentro dos parâmetros estabelecidos na monografia do produto.
Os relatórios de verificação e validação demonstram que o dispositivo atende aos requisitos de desempenho predeterminados. A evidência clínica está incluída no processo de desenvolvimento do produto e demonstra que o dispositivo é adequado para o uso pretendido.
A Análise de Risco foi usada em todas as fases do projeto para garantir que os princípios de segurança fossem tratados de forma adequada. Isso inclui design, proteção e os testes necessários para demonstrar a implementação bem-sucedida. As instruções de uso informam os usuários sobre os riscos residuais.
A membrana reabsorvível de colágeno estéril OstiumMAX Cover S é embalada em embalagem primária de PVC / alumínio não reutilizável. Suas características de alta resistência química, neutralidade, densidade e dureza, permitem grande inatividade com o conteúdo, e por sua vez, uma alta barreira de isolamento com o exterior. Na embalagem secundária de PET, o produto contido está claramente identificado com um rótulo.
Para manter o produto médico estéril até a implantação, OstiumMAX Cover S vem em embalagens triplas. Os produtos em suas embalagens primária e secundária são esterilizados com irradiação gama. Este sistema estéril (Conteúdo – 1º recipiente primário – 2º recipiente secundário) permite que o profissional autorizado, em conjunto com um campo cirúrgico adequado e boas práticas de implantação, forneça as condições assépticas adequadas para o sucesso da cirurgia.
OstiumMAX Cover S apresenta-se como um recipiente unidose, de forma que só pode ser usado uma vez, evitando que seja reutilizado em outra instância.
Registros
LEGAL Nº 2158 DE REGISTRO E AUTORIZAÇÃO DE FUNCIONAMENTO DA EMPRESA
CLÁUSULA 798: 2018 QUE HABILITA A EMPRESA E DESIGNAÇÃO DA GESTÃO TÉCNICA
CERTIFICADO DE CUMPRIMENTO DAS BOAS PRÁTICAS NA FABRICAÇÃO DE PRODUTOS MÉDICOS – ANMAT 3266: PROVISÃO 2013
REGISTRO DO PRODUTO: MEMBRANA REABSORVÁVEL DE COLÁGENO PM 2158-3.