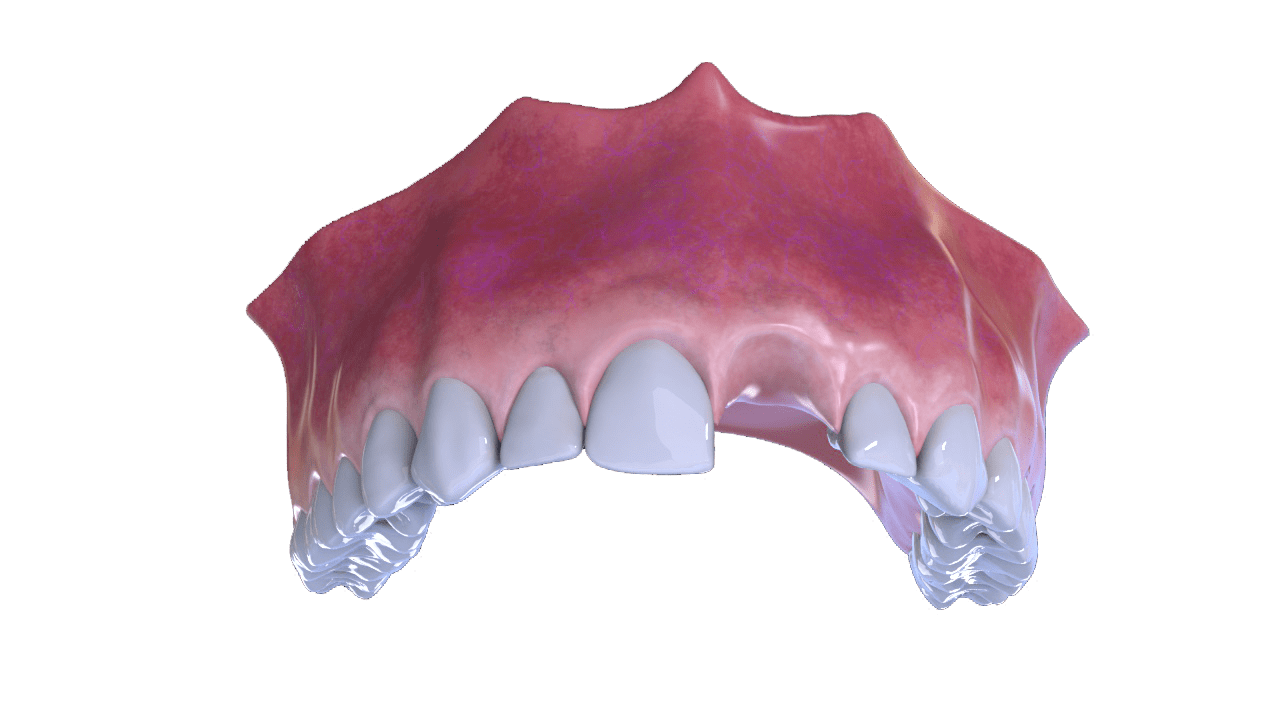
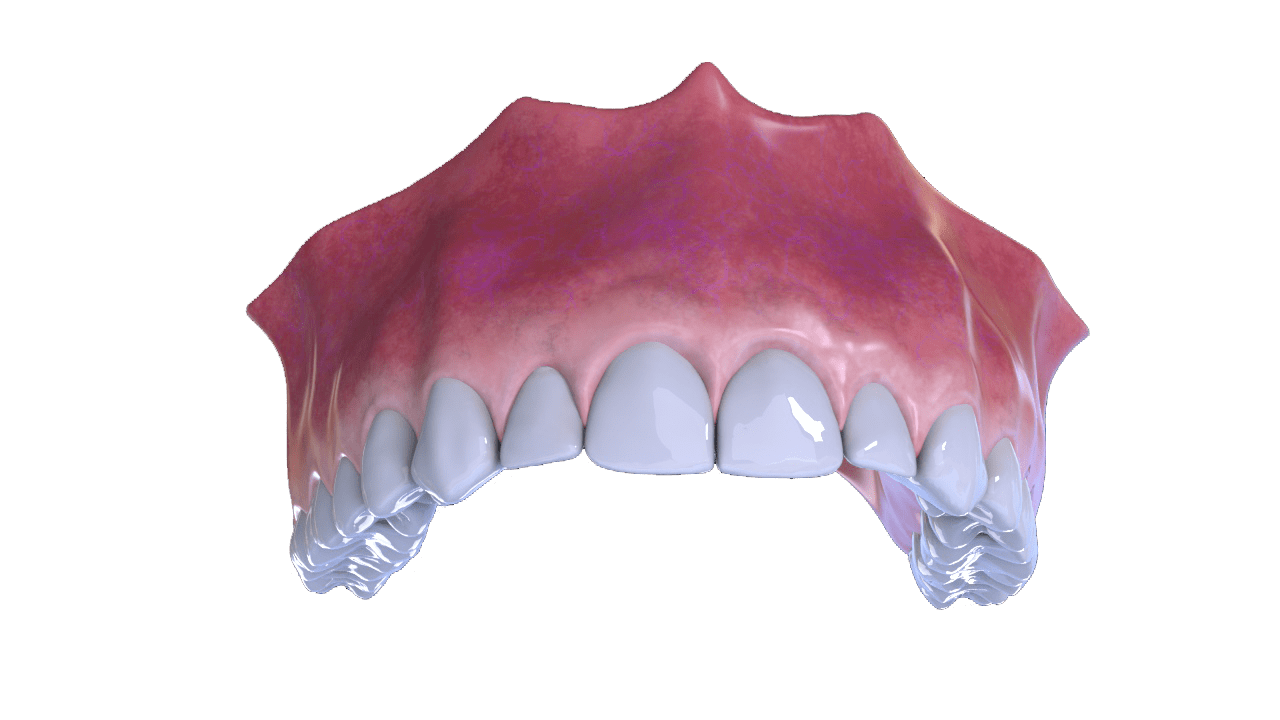
OstiumMAX Cover


COMPOSICIÓN:
Ostium Max Cover matriz de colágeno es un tejido blando (colágeno de origen porcino), esterilizado que desempeña una función de barrera adecuada de larga duración.
Gracias a un proceso de fabricación exclusivo, se conservan las propiedades superiores del colágeno porcino nativo sin alterar las características de este tejido natural. Su uso favorece y acelera la regeneración ósea ya que evita la invasión de tejido blando.
Ostium Max Cover matriz de colágeno es totalmente reabsorbible de manera que no se necesitan cirugías complementarias.
PRESENTACIÓN:
Unidades de 10x15mm x 1mm, 15x20mm x 1mm o 20x30mm x 1mm. Envasado en blister sellado.
APLICACIONES

Nota: Material para utilizar en su totalidad y en
un único receptor
Usos Previstos
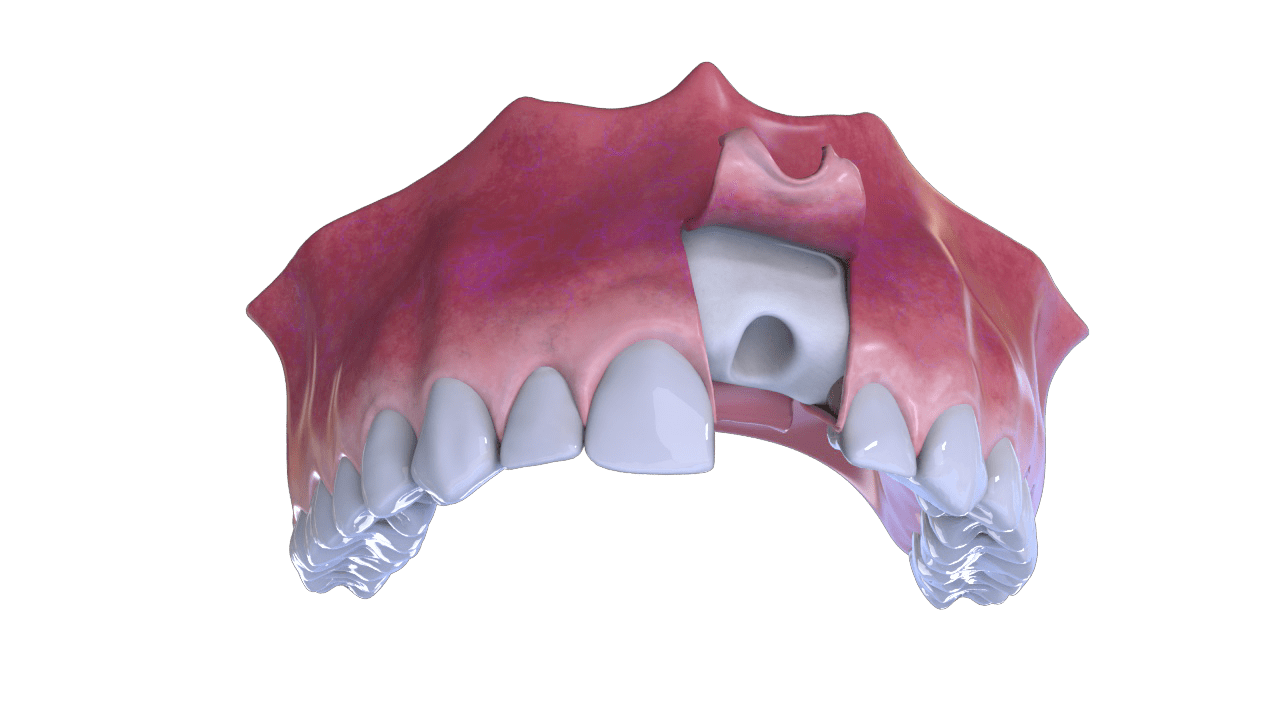
◦ Relleno de alvéolos postexodoncia.
◦ Implantología: preparación de sitios de implante, llenado de
dehiscencias óseas y elevación del suelo sinusal maxilar.
PROCEDIMIENTO
1°Paso
Incisión.
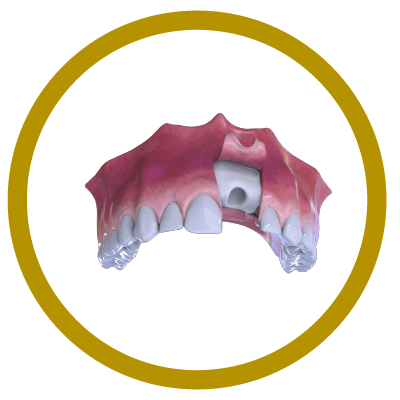
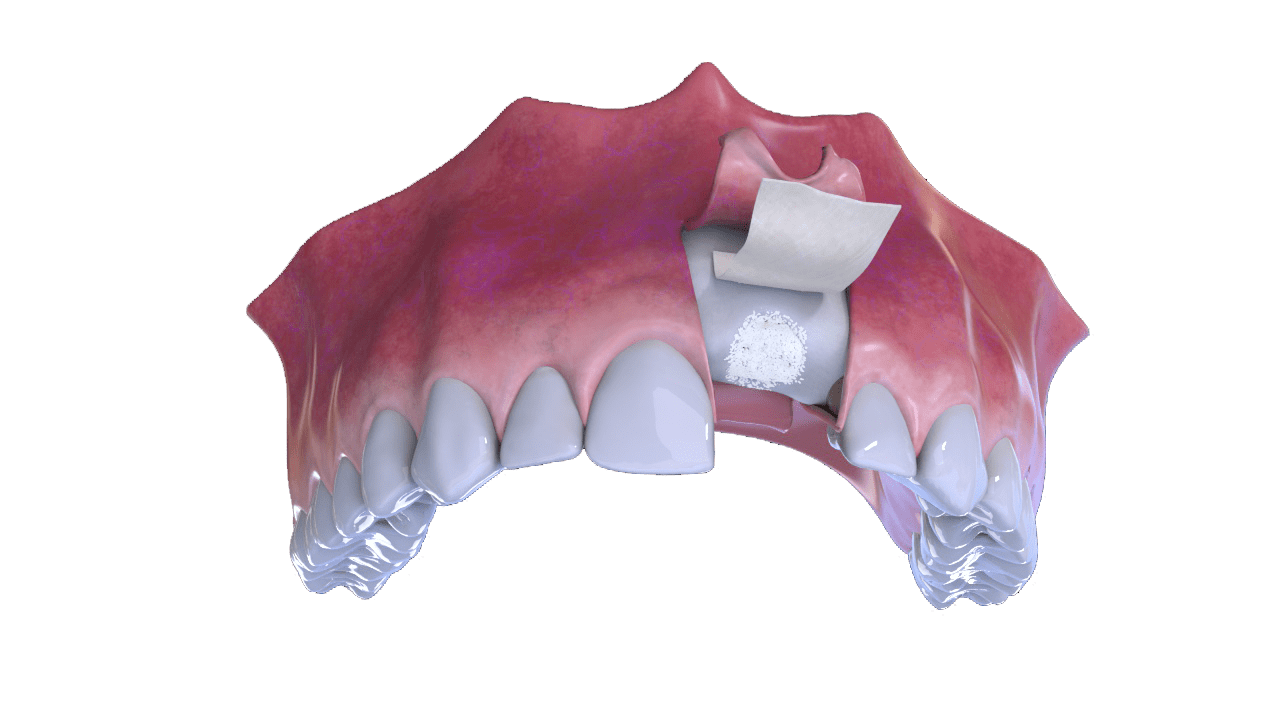
2° Paso
Colocación de Hueso y Membrana (Cover).
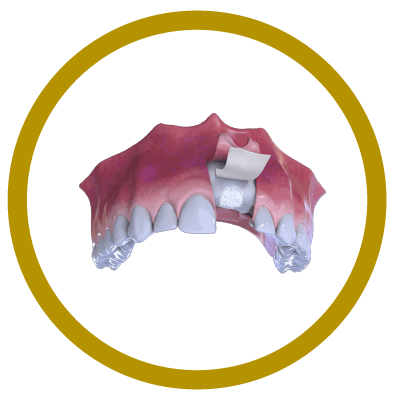
3° Paso
Colocación de Hueso y Membrana (Cover).
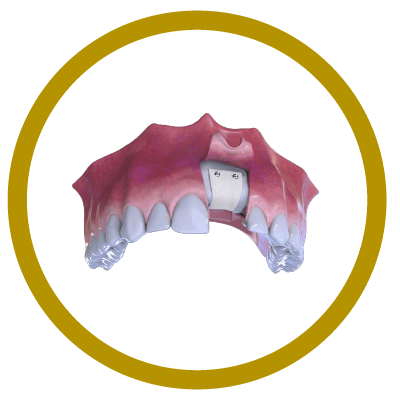
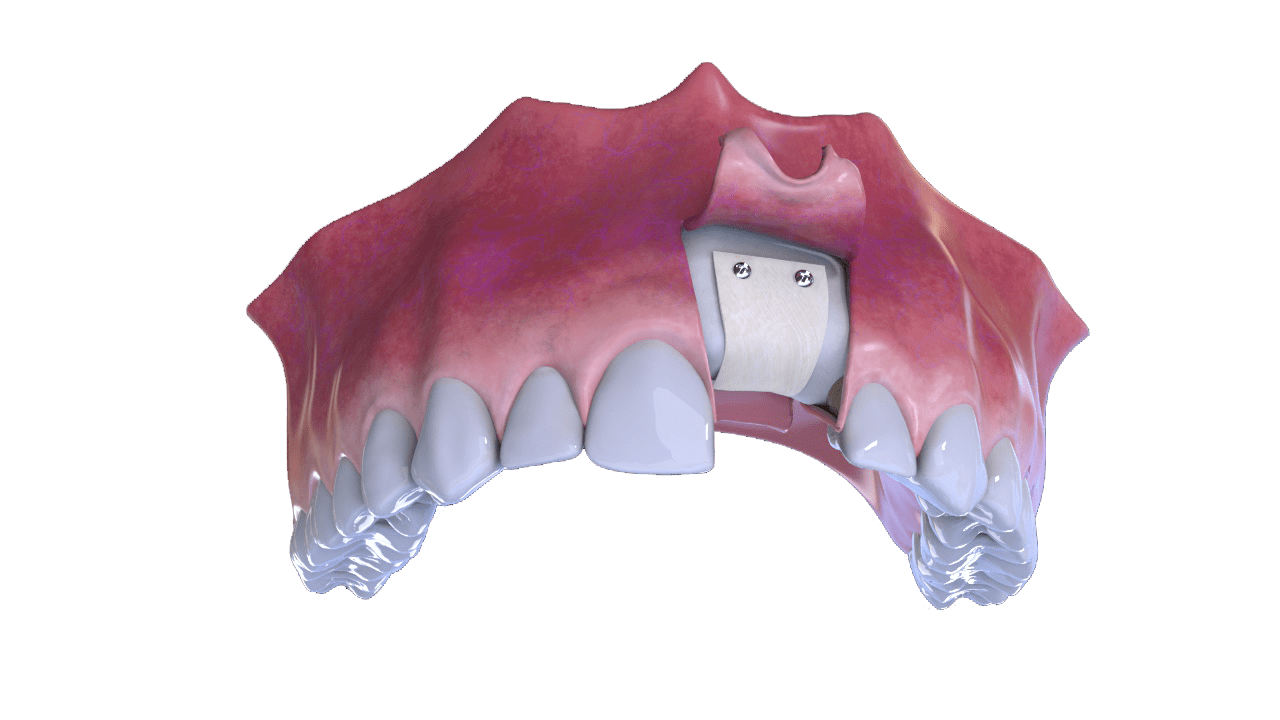
4° Paso
Sutura.
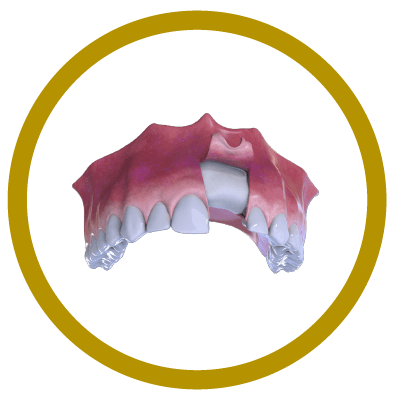
5° Paso
Neoformación Ósea.
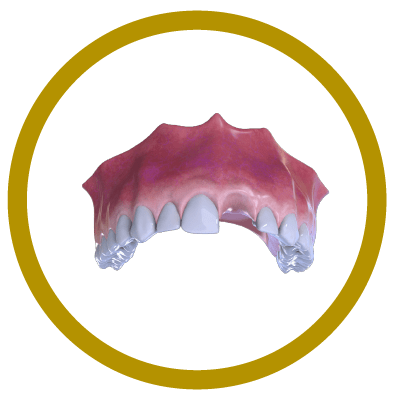
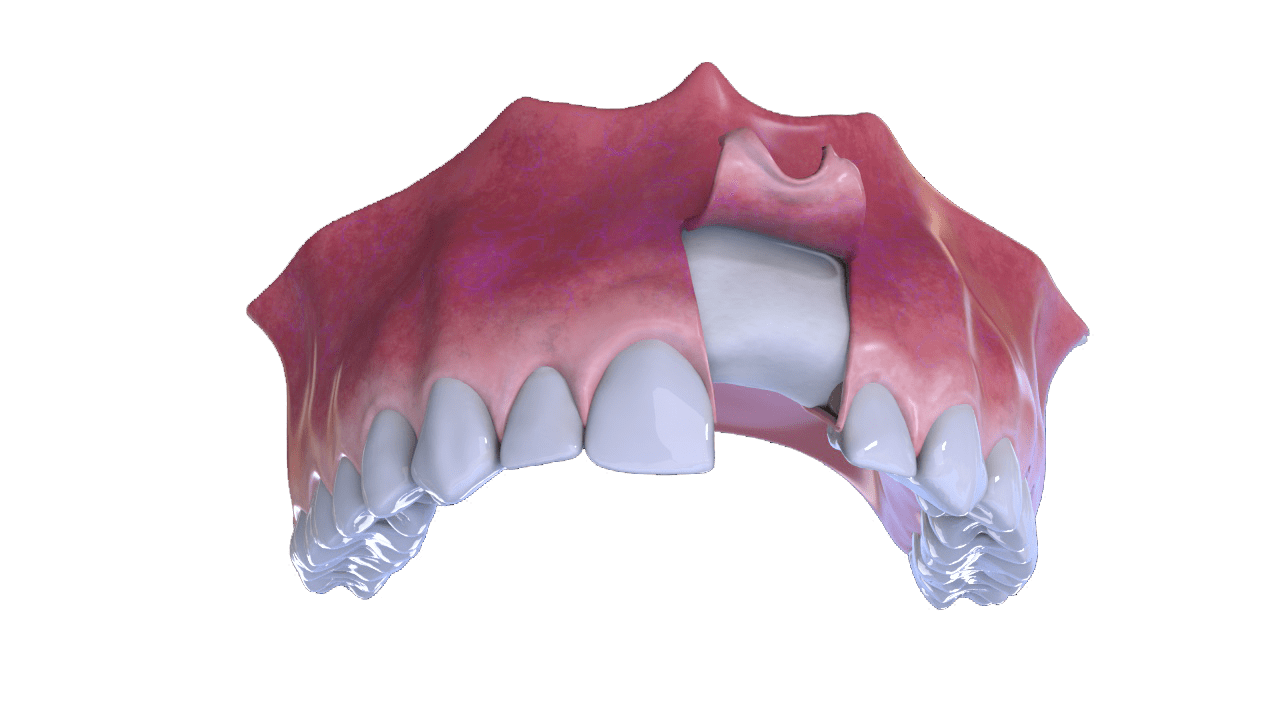
6° Paso
Finalización (Con Implante y Corona).
INFORMACIÓN TÉCNICA
Descarga Directa
Seguridad y Eficacia del producto Médico
La certificación de los animales de los cuales proviene la materia prima son originarios criados, alimentados y faenados dentro del territorio de la República Argentina. La materia prima se mantiene almacenada en freezers con controladores térmicos instalados que aseguran las condiciones de almacenamiento y mantienen el tejido porcino dentro de los parámetros establecidos en la monografía del producto.
Los informes de verificación y validación demuestran que el dispositivo cumple con los requisitos de rendimiento predeterminados. La evidencia clínica se incluye en el proceso de desarrollo de productos y demuestra que el dispositivo es adecuado para el uso destinado.
El Análisis de Riesgos se utilizó en todas las fases de diseño para asegurar que los principios de seguridad fueron abordadas adecuadamente. Esto incluye diseño, protección y las pruebas necesarias para demostrar la implementación exitosa. Las instrucciones de uso informan a los usuarios de los riesgos residuales.
La membrana reabsorbible de colágeno estéril OstiumMAX Cover se encuentra envasada en envase primario de PVC/ aluminio no reutilizable. Sus características de alta resistencia química, neutralidad, densidad y dureza, permiten gran inactividad con el contenido, y a su vez, una alta barrera de aislación con el exterior. En el envase secundario de PET, se identifica claramente con rótulo al producto contenido.
Para mantener el producto médico estéril hasta la implantación, OstiumMAX Cover se presenta con triple envases. El producto en su envase primario y secundario, son esterilizados con irradiación gamma. Este sistema estéril (Contenido – 1º envase primario – 2º envase secundario) permite disponer al profesional autorizado, junto a un campo quirúrgico apto y buenas prácticas de implantación, las condiciones de asepsia adecuadas para una cirugía exitosa.
OstiumMAX Cover se presenta como envase monodosis de manera tal que se asegure la utilización una sola vez, impidiendo ser reutilizado en otra instancia.
Registros
LEGAJO Nº 2158 DE INSCRIPCION Y AUTORIZACION DE FUNCIONAMIENTO DE EMPRESA
DISPOSICIÓN 798:2018 HABILITACIÓN DE EMPRESA Y DESIGNACIÓN DE DIRECCIÓN TÉCNICA
CERTIFICADO DE CUPLIMIENTO DE BUENAS PRACTICAS DE FABRICACIÓN DE PRODUCTOS MÉDICOS- DISPOSICIÓN ANMAT 3266:2013
REGISTRO DE PRODUCTO: MEMBRANA REABSORBIBLE DE COLÁGENO PM 2158-3.