OstiumMAX G


COMPOSICIÓN:
OstiumMAX es un mineral de hueso bovino. La estructura mineral osteoconductora altamente purificada se elabora a partir de hueso natural mediante un proceso de purificación de varias etapas que cumple estrictamente las normas de seguridad. Debido a su origen natural, OstiumMAX es comparable desde los puntos de vista químico y estructural al hueso humano mineralizado (apatita nanocristalina natural). La composición natural y el amplio volumen de poros interconectados favorecen la formación y el crecimiento de nuevo hueso en el sitio de implantación.
GRANULOMETRÍA:
1000 a 2380 micras. Tamaño de poro superior a las 100 micras.
PRESENTACIÓN:
1 g. (equivale a 2 cc)
Envasado en frasco vial de vidrio y blister sellado.
APLICACIONES

Nota: Material para utilizar en su totalidad y en
un único receptor
Usos Previstos
IMPLANTOLOGÍA:
Para la cobertura de la antrostomía y para la protección de injertos efectuados en defectos de dos paredes.
PERIODONCIA:
Protección de injertos en defectos infraóseos cuando la sutura de los bordes presenta riesgo de exposición.
Proporciona estabilización en la zona del injerto y una protección duradera contra agentes externos.
En la elevación de seno con acceso lateral, la membrana está indicada para cubrir la antrostomía y proteger la membrana del seno de riesgo de laceración a causa de la presión del injerto.
También se puede utilizar para proteger la regeneración perimplantaria y los injertos periodontales.
PROCEDIMIENTO
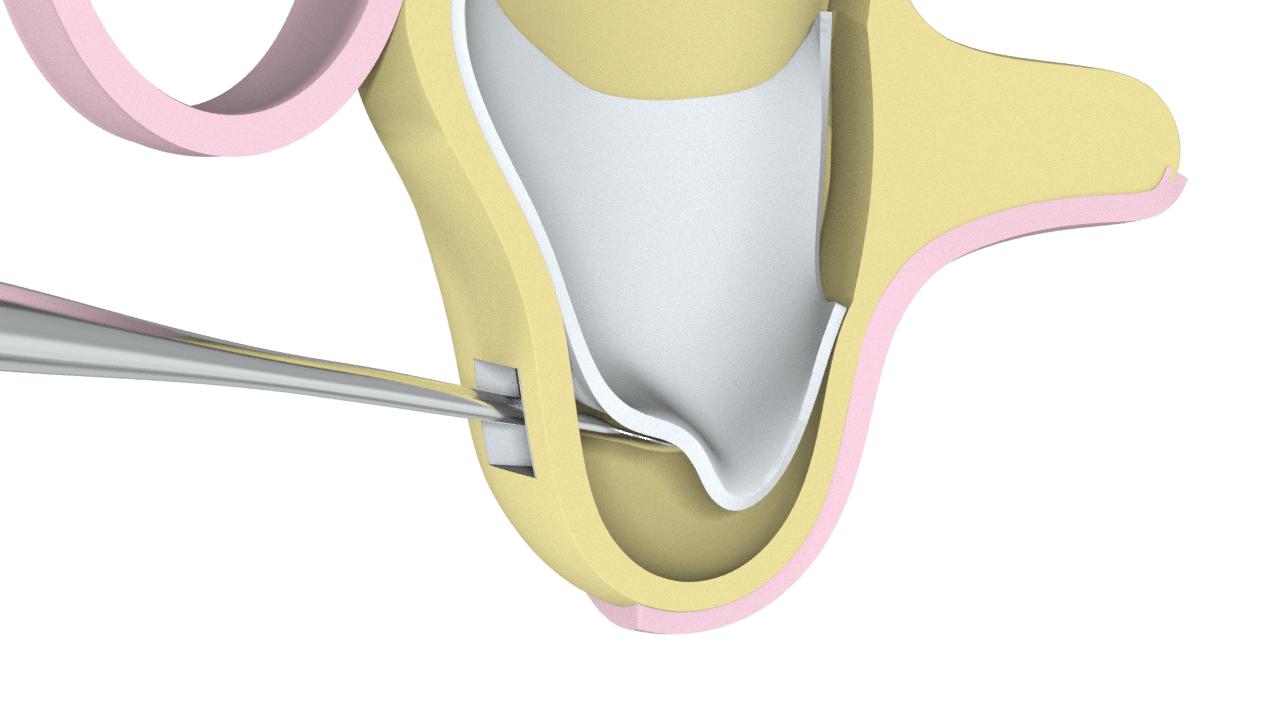
1° Paso
Abordaje en la cara lateral del Maxilar.
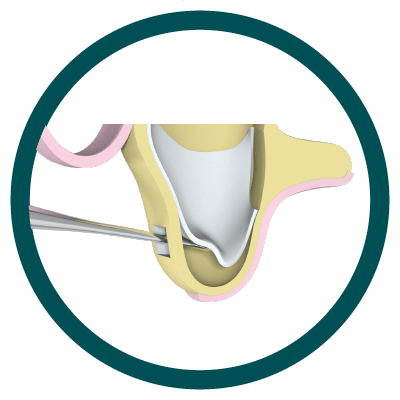
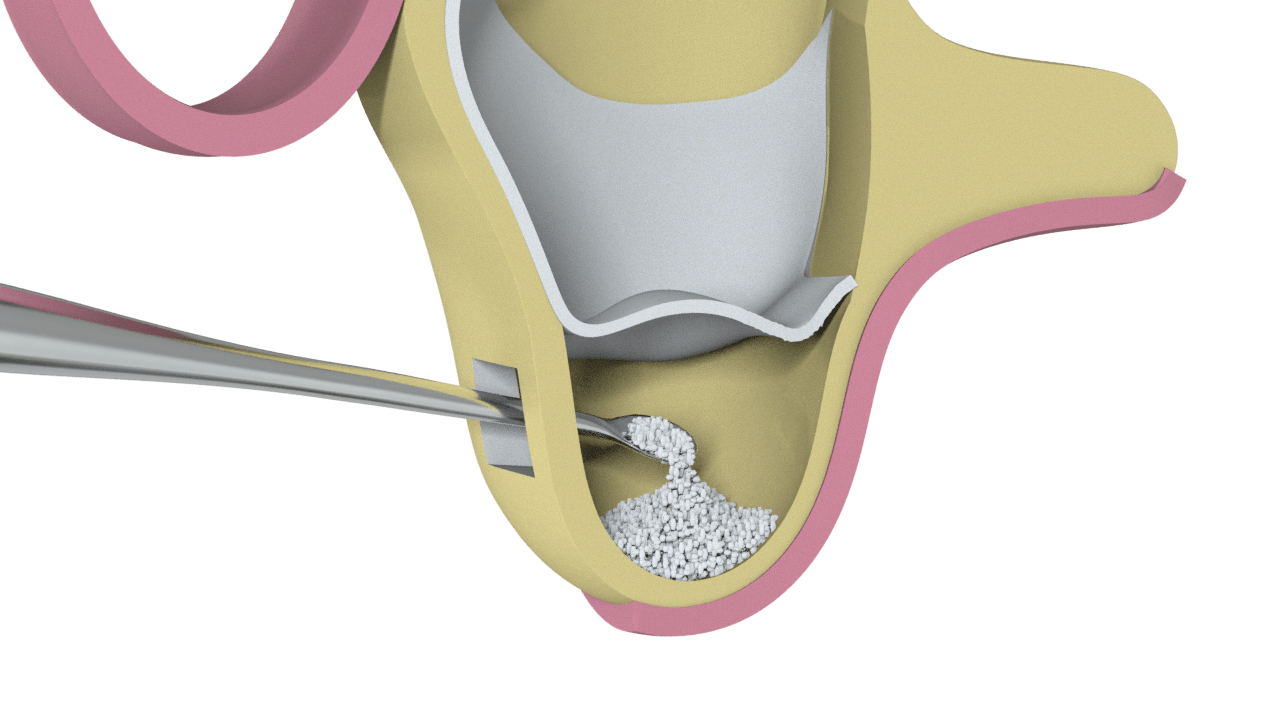
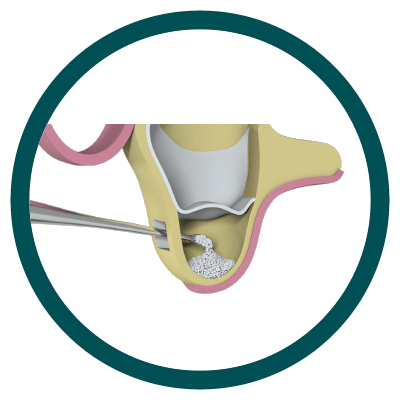
2° Paso
Colocación de Hueso Particulado (Ostium Max G).
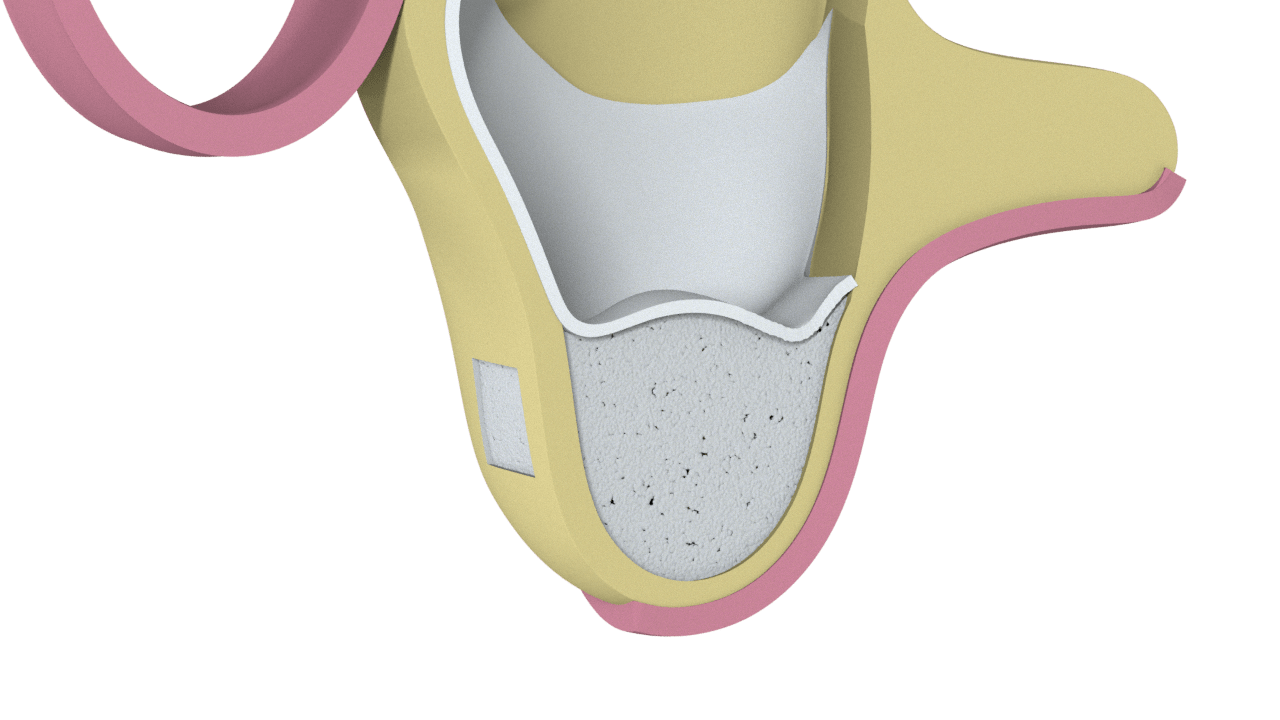
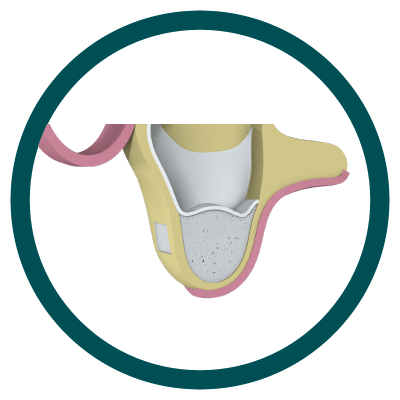
3° Paso
Hueso colocado y cierre de Ventana Lateral.
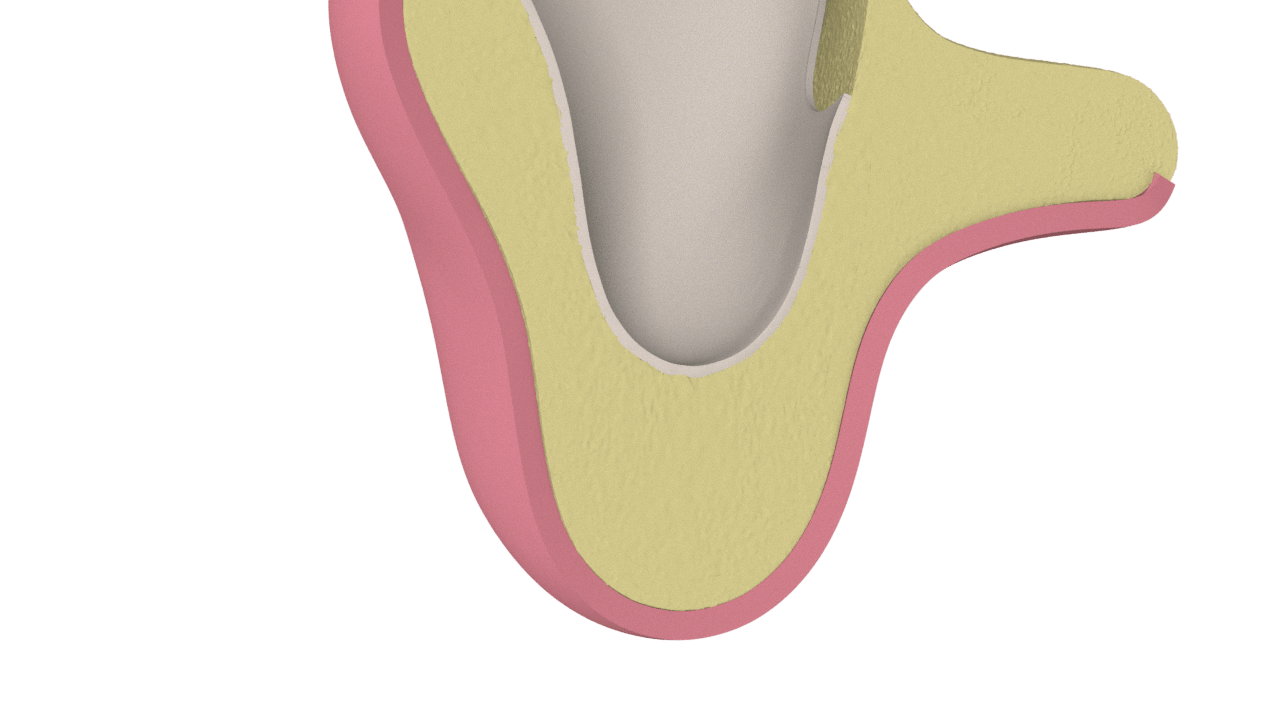
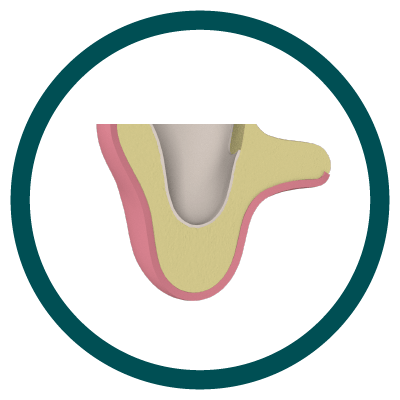
4° Paso
Neoformación Ósea (Cicatrización).
INFORMACIÓN TÉCNICA
Descarga Directa
Seguridad y Eficacia del producto Médico
La certificación de los animales de los cuales proviene la materia prima son originarios criados, alimentados y faenados dentro del territorio de la República Argentina, país libre de Encefalitis Espongiforme Bovina, más las condiciones de procesamiento, temperatura de calcinación e irradiación gamma ionizante, todo lo cual brinda el máximo nivel de seguridad relativo a la ausencia del Prion de la Encefalitis Espongiforme de origen Bovino. La materia prima se mantiene almacenada en freezers con controladores térmicos instalados que aseguran las condiciones de almacenamiento y mantienen el tejido bovino dentro de los parámetros establecidos en la monografía del producto. La hidroxiapatita Bovina estéril OstiumMAX G se encuentra envasada en envase primario de vidrio borosilicato, (bajo contenido alcalino) no reutilizable. Además, el tapón elastómero bromobutilo y precinto de seguridad, logran un complemento apto para asegurar la hermeticidad del envase.
Para mantener el producto médico estéril hasta la implantación, OstiumMAX G se presenta con blíster de matriz desarrollada especialmente con las medidas de nuestro envase primario, con un PET desarrollado especialmente para poder esterilizarse por radiación gamma, con alta resistencia química y térmica, de fácil apertura para mayor comodidad del profesional.
El conjunto es esterilizado con irradiación gamma lo que otorga las condiciones de asepsia adecuadas para una cirugía exitosa.
OstiumMAX G se presenta como envase monodosis de manera tal que se asegure la utilización una sola vez, impidiendo ser reutilizado en otra instancia.
Registros
LEGAJO Nº 2158 DE INSCRIPCION Y AUTORIZACION DE FUNCIONAMIENTO DE EMPRESA
DISPOSICIÓN 314:2014 HABILITACIÓN DE EMPRESA Y DESIGNACIÓN DE DIRECCIÓN TÉCNICA
CERTIFICADO DE CUPLIMIENTO DE BUENAS PRACTICAS DE FABRICACIÓN DE PRODUCTOS MÉDICOS-
DISPOSICIÓN ANMAT 3266:2013
REGISTRO DE PRODUCTO: OstiumMAX G PM 2158-1. DISPOSICIÓN ANMAT 4905:2018